В.А.Блатов, профессор, д.х.н.
Компьютерное обеспечение темы �Химическая связь и строение молекул� на уроках химии
При рассмотрении тем, связанных с теорией химической связи и строением различных классов химических соединений (неорганических, органических, комплексных) большую роль играет развитие у ученика наглядно-образного мышления и пространственного воображения. К сожалению, ни один, даже удачный и качественно выполненный рисунок молекулы не может дать полного представления о пространственном расположении атомов. Тем более трудно представить строение соединений с ионным или металлическим типом связи, характеризующихся сложной трехмерной кристаллической решеткой. Структурные формулы в этом случае, как правило, не отражают истинного строения соединения, так как координационные числа атомов зачастую оказываются существенно выше их формальной валентности. Например, структурная формула сульфата кальция CaSO4 (минерал ангидрит), записанная в виде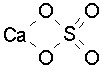 , правильно отражает только
координацию атома серы. Атом кальция в ангидрите
в действительности связан с восемью атомами
кислорода, а каждый атом кислорода � с тремя
атомами (с одним атомом серы и двумя атомами
кальция). Приведенная структурная формула
создает также неверное впечатление о типе,
кратности, длине и относительной прочности
химических связей Ca�O и S�O. Так, опираясь на нее,
можно предположить, что две связи S�O в
сульфат-ионе имеют в два раза большую кратность
(а, значит, гораздо короче и прочнее), чем две
другие связи. На самом деле кратность и прочность
всех четырех связей S�O абсолютно одинаковы (что
наглядно отражается тем, что их длины одинаковы и
равны 1.53A). В то же время структурная формула не
отражает действительно имеющегося различия
между длиной и прочностью связей Ca�O и S�O. В
структуре ангидрита связи с участием атомов
кальция существенно слабее, чем любая из связей
S�O. Это можно показать формальным расчетом
кратности связей каждого типа. Так как
двухвалентный атом кальция образует в структуре
кристалла 8 связей с атомами кислорода, то на
каждую такую связь (если для простоты считать их
равноценными) приходится 2/8=0.25 единицы
валентности кальция. Шестивалентный атом серы,
образуя четыре равноценных связи S�O,
затрачивает на каждую из них 6/4=1.5 единицы
валентности. Соответствующее количество единиц
валентности тратит на каждую связь и атом
кислорода (1.5+2�0.25=2), также полностью реализуя
свои валентные возможности. Таким образом,
каждая связь Ca�O имеет кратность в шесть раз
меньшую, чем связи S�O. Это выражается также и в
различии длин указанных связей (длины двух
неравноценных связей Ca�O, равные 2.32 и 2.61A
существенно выше, чем приведенная выше длина
связей в сульфат-ионе).
, правильно отражает только
координацию атома серы. Атом кальция в ангидрите
в действительности связан с восемью атомами
кислорода, а каждый атом кислорода � с тремя
атомами (с одним атомом серы и двумя атомами
кальция). Приведенная структурная формула
создает также неверное впечатление о типе,
кратности, длине и относительной прочности
химических связей Ca�O и S�O. Так, опираясь на нее,
можно предположить, что две связи S�O в
сульфат-ионе имеют в два раза большую кратность
(а, значит, гораздо короче и прочнее), чем две
другие связи. На самом деле кратность и прочность
всех четырех связей S�O абсолютно одинаковы (что
наглядно отражается тем, что их длины одинаковы и
равны 1.53A). В то же время структурная формула не
отражает действительно имеющегося различия
между длиной и прочностью связей Ca�O и S�O. В
структуре ангидрита связи с участием атомов
кальция существенно слабее, чем любая из связей
S�O. Это можно показать формальным расчетом
кратности связей каждого типа. Так как
двухвалентный атом кальция образует в структуре
кристалла 8 связей с атомами кислорода, то на
каждую такую связь (если для простоты считать их
равноценными) приходится 2/8=0.25 единицы
валентности кальция. Шестивалентный атом серы,
образуя четыре равноценных связи S�O,
затрачивает на каждую из них 6/4=1.5 единицы
валентности. Соответствующее количество единиц
валентности тратит на каждую связь и атом
кислорода (1.5+2�0.25=2), также полностью реализуя
свои валентные возможности. Таким образом,
каждая связь Ca�O имеет кратность в шесть раз
меньшую, чем связи S�O. Это выражается также и в
различии длин указанных связей (длины двух
неравноценных связей Ca�O, равные 2.32 и 2.61A
существенно выше, чем приведенная выше длина
связей в сульфат-ионе).
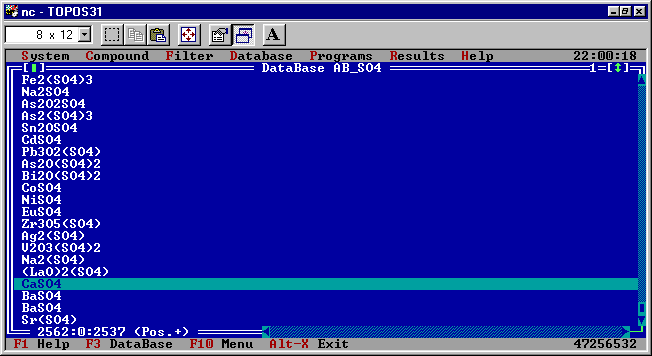
Описанный анализ строения одного из типичных неорганических соединений показывает, сколько �подводных камней� может таиться в вопросе об особенностях межатомных связей даже в веществах, обладающих достаточно простой химической формулой. Поэтому, пускаясь в полное неожиданностей плавание по бескрайнему океану разнообразных химических соединений, желательно обзавестись хорошим лоцманом. В научном мире в качестве таких �лоцманов� общепризнаны компьютерные базы данных, содержащие подробные сведения о строении всех веществ, изученных до настоящего времени. Наиболее крупными из них данных являются: Кембриджская база структурных данных (Великобритания, более 190 тыс. органических и комплексных соединений), База кристаллоструктурных данных по неорганическим соединениям (Германия, почти 50 тыс. веществ), База данных по строению металлов и сплавов (Канада, более 50 тыс. записей) и Банк данных по высокомолекулярным соединениям (США, более 8 тыс. молекул белков и нуклеиновых кислот). Все перечисленные базы данных включают компьютерные программы, позволяющие изображать, вращать, масштабировать структуры соединений, проводить расчеты длин межатомных связей, валентных углов и других геометрических характеристик. До недавнего времени в России аналогичных программ и баз данных не было. Однако с 1997 г. кафедра неорганической химии Самарского государственного университета начала распространение комплекса компьютерных программ для структурного анализа химических соединений TOPOS, по своим возможностям не уступающего зарубежным аналогам, а по ряду характеристик превосходящего их. Облегченная версия комплекса, предназначенная для использования в средних школах, включает базу данных по строению типичных представителей всех основных классов химических веществ (от металлов до белков) и программу IsoCryst, позволяющую проводить многочисленные операции с изображением структуры соединения. На рис.1 приведен типичный вид окна базы данных TOPOS, а на рис.2 � фрагмент структуры ангидрита, изображенный при помощи программы IsoCryst. Более подробную информацию о комплексе TOPOS можно найти на Web-странице кафедры неорганической химии. Бесплатную демонстрационную версию комплекса можно получить на FTP-сервере Самарского государственного университета.

Рис.1. Общий вид окна TOPOS с загруженной базой данных.
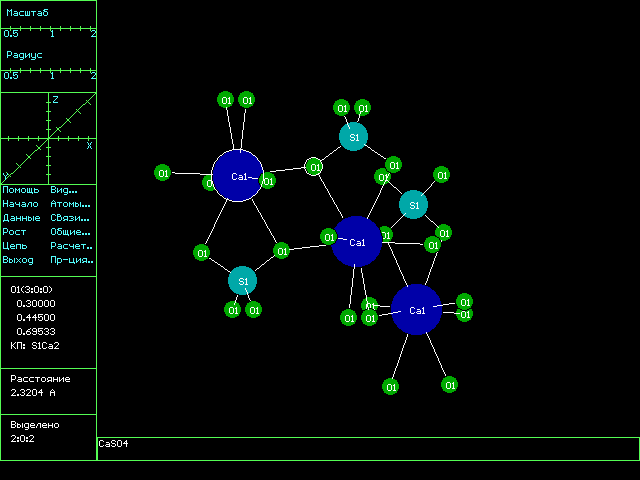
Рис.2. Вид окна программы IsoCryst с фрагментом структуры ангидрита.