Isolatie van antibiotica door middel van selectieve complexatie
Op de Katholieke Universiteit Nijmegen wordt op de afdeling Organische Chemie (Prof.dr. B. Zwanenburg) van de subfaculteit Scheikunde in drie deelprojecten onderzoek gedaan aan de productie van antibiotica uit de familie van cefalosporines. Dit onderzoek vindt plaats binnen het clusterproject Fijnchemie*. Eén van de deelprojecten, het promotieonderzoek van Gerjan Kemperman, is gericht op de "groene" isolatie van antibiotica uit reactiemengsels en afvalstromen. Hij werkt hierbij samen met René de Gelder, UD bij de afdeling Anorganische Chemie (Prof.dr. A.W. Gal).
Een nadeel van de huidige productiemethoden voor de genoemde antibiotica is de grote hoeveelheid chemisch afval welke onstaat tijdens de chemische synthese in fabrieken. Nieuwe (toekomstige) regelgeving vanuit de overheid vraagt om schonere processen met beduidend minder chemisch afval. Dit kan door de inzet van enzymen welke in staat zijn uit de juiste moleculaire bouwstenen rechtstreeks antibiotica te maken. Ook is er, onder druk van de wereldwijde concurrentie, behoefte aan nieuwe, efficiëntere productieprocessen. Dit kan bereikt worden door iedere stap in het productieproces zo optimaal mogelijk en zo goedkoop mogelijk te laten verlopen. Fundamenteel onderzoek is noodzakelijk om dit te kunnen realiseren.
Bij de milieuvriendelijke productie van antibiotica m.b.v. enzymen worden de moleculaire bouwstenen, vaak aangeduid als de "kern" en de "staart", aan elkaar gekoppeld met behulp van een geschikt enzym. Deze koppelingsreactie wordt uitgevoerd in "gewoon" water en niet in een giftig oplosmiddel, zoals bij de conventionele productie van antibiotica. Zonder het enzym vindt de koppeling van kern en staart niet plaats. Het probleem bij het gebruik van het enzym is dat het ook het gevormde antibioticum weer af kan breken, waarbij ongewenste bijproducten ontstaan en lagere opbrengsten verkregen worden. Een bijkomend probleem is dat het gevormde antibioticum zeer goed oplosbaar is in water en niet automatisch als te isoleren product, dus als vaste stof, ontstaat. Deze problemen vormen het uitgangspunt van Gerjan Kemperman's promotieonderzoek: hoe isoleer ik zo snel en zo efficiënt mogelijk het product, het antibioticum, uit de waterige soep bestaande uit enzym, grondstoffen, bijproducten etc.
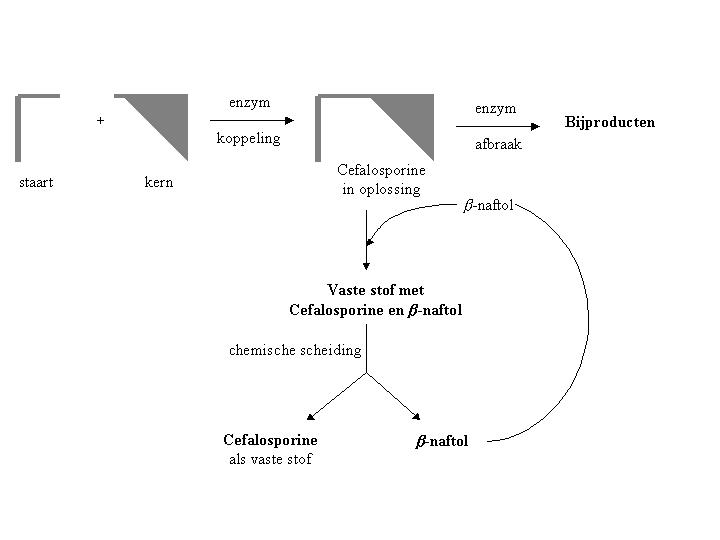
Een mogelijke oplossing van het probleem van de isolatie is schematisch weergegeven in Figuur 1. Er is al een tijdje bekend dat de stof b -naftol in staat is antibiotica uit de familie van cefalosporines te binden: er ontstaat een vaste stof indien b -naftol wordt toegevoegd aan een oplossing van deze antibiotica. Opvallend hierbij is dat b -naftol alleen met het cefalosporine een vaste stof vormt en niet met de uitgangsstoffen (de kern en de staart). Blijkbaar treedt er moleculaire herkenning op tussen de b -naftol moleculen en de cefalosporine moleculen. Dit proces wordt selectieve complexatie genoemd. De vaste stof kan eenvoudig uit de oplossing worden gefiltreerd en na een chemische scheiding kan het antibioticum zuiver verkregen worden en kan het b -naftol worden gerecycled. Precies wat we zoeken, ware het niet dat er ernstige bezwaren aan de hulpstof b -naftol kleven.

Figuur 1
In de eerste plaats verloopt het selectieve complexatie proces, indien je b -naftol gebruikt, niet voor alle cefalosporines even efficiënt. Bovendien is b -naftol zelf een tamelijk giftige en niet-milieuvriendelijke stof en past het dus niet in het nieuwe "groene" productieproces van antibiotica. Daarom diende het isolatieproces aanmerkelijk verbeterd te worden.
Allereerst is het noodzakelijk dat begrepen wordt hoe de selectieve complexatie sowieso in zijn werk gaat. Aanvankelijk werd aangenomen dat de b -naftol moleculen een rooster vormen waarin de cefalosporine moleculen zich nestelen. Als dit zo zou zijn, dan zouden op basis daarvan verbeteringen te maken moeten zijn. Men zou de b -naftol moleculen eventueel eerst zelf kunnen binden aan een dragermateriaal en zodoende kunnen voorkomen dat "losse" b -naftol moleculen in het reactiemengsel terecht komen.
Om erachter te komen hoe de antibiotica moleculen vastgehouden worden door de b -naftol moleculen kan men met Röntgenstraling de vaste stof, die tijdens het complexeren ontstaat, onderzoeken en zelfs afbeeldingen verkrijgen van de afzonderlijke moleculen indien men kristallen van de stof in handen heeft. Er werd eerst getracht geschikte kristallen te maken van de vaste stof bestaande uit cefalosporine en b -naftol. Van deze kristallen werd vervolgens de moleculaire structuur opgehelderd met behulp van Röntgendiffractie. Aan de kristalstructuur, schematisch weergegeven in Figuur 2, kon direct worden gezien dat niet de b -naftol moleculen maar de cefalosporine moleculen de rol van gastheer op zich nemen: zij sluiten juist de b -naftol moleculen in. Wanneer de cefalosporine moleculen bij elkaar komen onstaat een structuur met daarin holtes waarin b -naftol als gastmolecuul gehuisd kan worden. Als b -naftol niet in deze holtes gaat zitten is de structuur, gevormd door de cefalosporine moleculen, niet stabiel en valt deze uit elkaar. Er wordt dan geen vaste stof gevormd en de cefalosporine moleculen blijven in oplossing. Dit is dus precies het omgekeerde van wat aanvankelijk werd aangenomen en het idee van het immobiliseren van b -naftol ter verbetering van het isolatieproces moest hierdoor worden verlaten.
Op basis van de gevonden resultaten kon nu wel worden gekozen voor een andere aanpak van het complexatie onderzoek. Dit werd gedaan door te zoeken naar andere moleculen die de holtes in de cefalosporine structuur nog beter "opvullen" dan b -naftol. Allereerst moet dan heel nauwkeurig worden gekeken naar de holte, waarin b -naftol gevonden wordt. Een geschikt molecuul moet niet alleen qua vorm en grootte passen maar moet ook chemisch gezien zich schikken naar de antibiotica moleculen. Met behulp van moleculaire modellering op de computer en chemische intuïtie werden nieuwe moleculen gevonden die vaak efficiënter de antibiotica weten te complexeren dan b -naftol. Er werd tevens gevonden dat drie van de vier antibiotica vele gastmoleculen toelaten maar dat het vierde antibioticum zeer kieskeurig was. Hiervoor kon later een verklaring gegeven worden op basis van de kristalstructuren. Het blijkt dat de drie "tolerante" antibiotica zich min of meer kunnen aanpassen aan het gastmolecuul. Voor zowel het kieskeurige antibioticum als voor de andere drie konden nieuwe moleculen gevonden worden die veel efficiënter complexeerden maar helaas nog steeds giftig en niet milieuvriendelijk waren. Deze verbeteringen leidden echter wel tot de aanvraag van een tweetal patenten.
Er was inmiddels veel fundamentele kennis vergaard over hoe de antibiotica zich tijdens het complexeren gedragen en welke structuren ze in de vaste stof kunnen vormen. Duidelijk was echter dat voor een werkelijke toepassing een complexatiestof aan allerlei industriële eisen moet voldoen. Het moet goedkoop zijn, niet giftig, werkzaam bij de juiste pH, op grote schaal verkrijgbaar, zeer efficiënt zijn en niet het enzym storen bij de werking. Door te speuren naar nieuwe structuren waarin de cefalosporines zich tezamen met de gastmoleculen formeren kon een klasse van kleinere moleculen gevonden worden waarin het succes op het vinden van het "droommolecuul" veel groter was. Inmiddels zijn er een aantal b -naftol vervangers ontdekt die zowel efficiënt als ook onschadelijk, milieuvriendelijk en niet te vergeten goedkoop zijn, en dus feitelijk toepasbaar zijn in een industrieel proces. Er is zelfs een geschikte verbinding met een E-nummer gevonden. Een aantal van deze stoffen wordt op dit moment onder procescondities getest bij DSM.
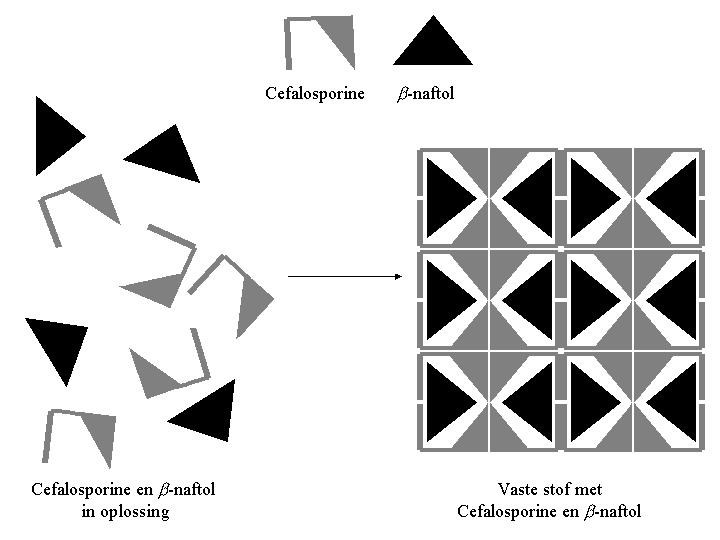
Figuur 2
Om zelfs te komen tot het doen van voorspellingen omtrent het complexerend vermogen van nieuwe b -naftol vervangende moleculen, is een samenwerking aangegaan met Ron Wehrens, UD bij de afdeling Analytische Chemie (Prof.dr. L.C.M. Buydens). Deze samenwerking is er op gericht een model te ontwikkelen waarmee met behulp van de computer bepaald kan worden, op basis van de informatie die we op dit moment hebben, of een bepaald molecuul wel of niet een complex kan vormen met de cefalosporines. Dit zou het testen van nieuwe kandidaatverbindingen in het laboratorium aanmerkelijk kunnen versnellen en zou de speurtocht naar het "droommolecuul" objectiever maken. Men zou zelfs kunnen denken aan het geautomatiseerd screenen van een chemische database op potentiële kandidaatmoleculen. Inmiddels is het mogelijk om met een grote betrouwbaarheid een uitspraak te doen over het wel of niet complexeren van een nieuw molecuul.
Industrieel gezien is een goed complexatieproces niet alleen zeer waardevol tijdens de enzymatische synthese van antibiotica (tijdens de koppeling van kern en staart in het reactievat). Het kan ook worden gebruikt om resten cefalosporines te verwijderen uit afvalstromen verderop in het proces, waarbij zowel economisch als voor wat betreft het milieu winst wordt geboekt.
Gerjan Kemperman (Organische Chemie)
René de Gelder (Anorganische Chemie/Kristallografie)